自体免疫细胞疗法
增殖和强化「攻击部队」细胞
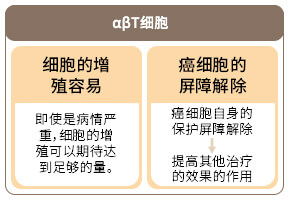
αβ T细胞疗法是「活性化自体淋巴细胞疗法」之一,在体外大量增殖对癌细胞攻击力最强的T细胞,然后再回输到体内。 T细胞中较多是αβ T细胞,因此这疗法以此命名。由于αβ T细胞是一种对包括癌细胞在内的所有异常细胞进行攻击的免疫细胞,所以具有综合提高免疫细胞功能的效果。同时可以解除癌细胞对免疫的抑制作用 (癌细胞保护自己的屏障),创造有效的免疫功能环境 。
使用Alpha·Beta T细胞疗法
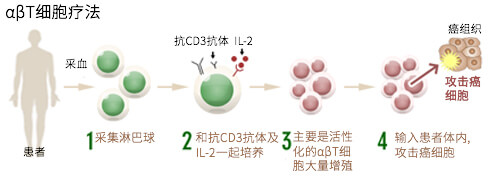
αβ T细胞疗法在日本国内是应用时间最长的疗法之一,所以对其的有效性和效果的界限是最清楚和成熟的。同时,此疗法的优点是αβ T细胞相对容易培养、需要的血量少和培养时间短。虽然存在个人差异,但经过两周的培养,一般会从200万个αβ T细胞增加到80亿个。因此,某些病情严重或者接受强烈的化学疗法后等原因导致血液中淋巴细胞的数量和机能下降等情况亦可透过αβ T细胞疗法来增加到充分的细胞数量。
创造有效的免疫功能环境
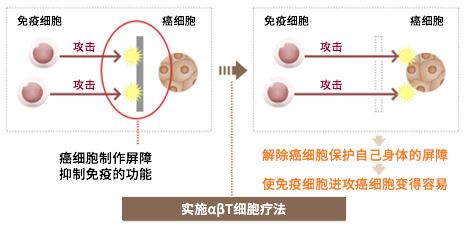
癌细胞为了保护自己而启动了抑制免疫功能的机制。为了提高免疫细胞治疗的效果,解除这种抑制作用是关键。在最近的研究中,具有解除免疫抑制作用的药物免疫治疗受到极大的关注,而αβT细胞疗法也同时有解除这种免疫抑制的作用,提高免疫治疗的效果。
癌细胞对免疫机能的抑制作用
人类的身体具有攻击癌症等异常细胞的免疫功能。但是,如果它攻击过度的话,会给正常的细胞带来伤害的危险,所以在我们的免疫系统有能够自我抑制攻击的构造(这种机制不能发挥作用的例子是类风湿关节炎和花粉症等自身免疫性疾病)。癌细胞最难对付的是它会利用免疫抑制来保护自己免受免疫细胞攻击。因此,解除这种抑制作用是提高免疫细胞治疗效果的关键。
备受世界瞩目的解除免疫抑制的药物
目前,具有解除免疫抑制作用的药物免疫治疗受到极大的关注。阻碍担当免疫抑制的蛋白质「PD-1」和「CTLA4」(※) 抗体药物Nivolumab(通用名)和Ipilimumab(通用名)是其代表例子。 Nivolumab在2014年被批准作为医药品的制造销售,Ipilimumab 在美国等40多个国家得到批准。这些关于免疫治疗的成果引起了全世界的关注,美国权威科学杂志《科学》,在2013年的Breakthroug of the year 中,提出了「对癌症的免疫治疗」。而在最近的研究中亦显示αβT细胞疗法(活性化自体淋巴细胞疗法之一)也有解除这种免疫抑制的作用。
减少免疫抑制细胞的比例
免疫细胞中被称为Treg(调节性T细胞;抑制性T细胞)的细胞是作为担当免疫抑制作用的细胞。研究结果显示通过实施αβT细胞疗法是会使这种Treg细胞减少。
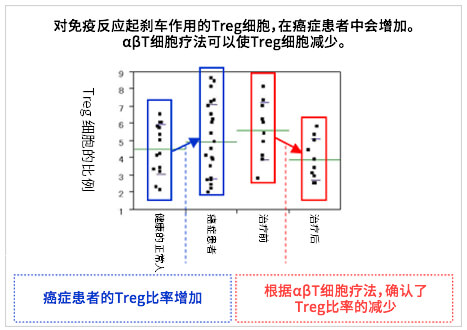
根据这个研究结果,在癌症患者中负责担当攻击癌细胞的T细胞与健康者相比,一方面有异常的减少,另一方面抑制对癌细胞的攻击的Treg并没有减少,相反有增加的情况。通过αβT细胞疗法被输入的细胞是负责攻击癌细胞的杀伤性T细胞和辅助性T细胞,几乎不包含Treg。通过进行αβT细胞疗法可以充分增加攻击所需的T细胞,提高攻击力并减少Treg的比例。通过减少Treg可以创造有效的免疫功能环境 。另外,αβT细胞疗法作为活性化自体淋巴细胞疗法之一被长期实施,对于树突状细胞疫苗疗法等其他治疗方法的效果发挥来说也是不可缺少的。根据研究结果显示,这疗法在提高免疫治疗的效果上发挥很大的作用。
(※)被称为「PD-1」「CTLA4」「PD-1」以及「CTLA4」的蛋白质,在免疫细胞攻击开始后不久,会出现在进行攻击的免疫细胞「T细胞」表面。当它另一个免疫细胞「抗原提示细胞」表面的特定蛋白质结合时,攻击中止的指令就会传递给T细胞。另一方面,癌细胞本身也会把与PD-1结合的蛋白质露出表面,从而让T细胞停止攻击它。它们控制着免疫细胞受控,所以也被称为「免疫检查点」。
资料来源:
Iwai Y, Hamanishi J, Chamoto K, Honjo T. Cancer immunotherapies targeting the PD-1 signaling pathway. J Biomed Sci. 2017 Apr 4;24(1):26. doi: 10.1186/s12929-017-0329-9. PMID: 28376884; PMCID: PMC5381059.
Sharma P, Allison JP. Immune checkpoint targeting in cancer therapy: toward combination strategies with curative potential. Cell. 2015 Apr 9;161(2):205-14. doi: 10.1016/j.cell.2015.03.030. PMID: 25860605; PMCID: PMC5905674.
Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science. 2013 Dec 20;342(6165):1432-3. doi: 10.1126/science.342.6165.1432. PMID: 24357284.
Kamigaki T, Matsuda E, Okada S, Naitoh K, Kondo T, Ibe H, Maekawa R, Goto S. Prospective evaluation of safety of immune-cell therapy for patients with various types of advanced cancer. Anticancer Res. 2014 Aug;34(8):4601-7. PMID: 25075106.
Kamigaki T, Ibe H, Okada S, Matsuda E, Tanaka M, Oguma E, Kinoshita Y, Ogasawara S, Ono A, Makita K, Naitoh K, Goto S. Improvement of Impaired Immunological Status of Patients with Various Types of Advanced Cancers by Autologous Immune Cell Therapy. Anticancer Res. 2015 Aug;35(8):4535-43. PMID: 26168498.
Takimoto R, Kamigaki T, Okada S, Matsuda E, Ibe H, Oguma E, Naitoh K, Makita K, Goto S. Efficacy of Adoptive Immune-cell Therapy in Patients with Advanced Gastric Cancer: A Retrospective Study. Anticancer Res. 2017 Jul;37(7):3947-3954. DOI: 10.21873/anticanres.11778. PMID: 28668899.
Dammeijer F, Lievense LA, Veerman GD, Hoogsteden HC, Hegmans JP, Arends LR, Aerts JG. Efficacy of Tumor Vaccines and Cellular Immunotherapies in Non-Small-Cell Lung Cancer: A Systematic Review and Meta-Analysis. J Clin Oncol. 2016 Sep 10;34(26):3204-12. doi: 10.1200/JCO.2015.66.3955. Epub 2016 Jul 18. PMID: 27432922

